LA MATERIA | |
CLASIFICACIÓN DE LA MATERIA |  |
La materia la podemos encontrar en la naturaleza en forma de sustancias puras y de mezclas.
* Las sustancias puras son aquéllas cuya naturaleza y composición no varían sea cual sea su estado. Se dividen en dos grandes grupos: Elementos y Compuestos.
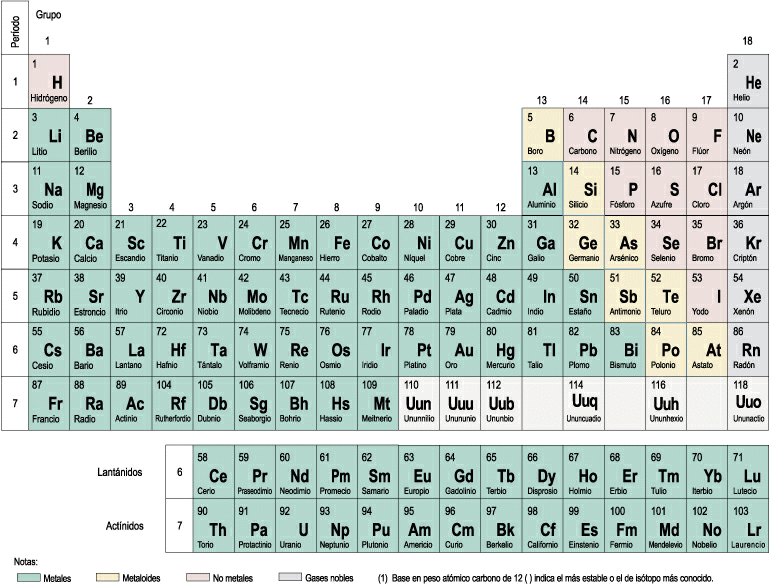
- Elementos: Son sustancias puras que no pueden descomponerse en otras sustancias puras más sencillas por ningún procedimiento. Ejemplo: Todos los elementos de la tabla periódica: Oxígeno, hierro, carbono, sodio, cloro, cobre, etc. Se representan mediante su símbolo químico y se conocen 115 en la actualidad.
- Compuestos: Son sustancias puras que están constituidas por 2 ó más elementos combinados en proporciones fijas. Los compuestos se pueden descomponer mediante procedimientos químicos en los elementos que los constituyen. Ejemplo: Agua, de fórmula H2O, está constituida por los elementos hidrógeno (H) y oxígeno (O) y se puede descomponer en ellos mediante la acción de una corriente eléctrica (electrólisis). Los compuestos se representan mediante fórmulas químicas en las que se especifican los elementos que forman el compuesto y el número de átomos de cada uno de ellos que compone la molécula.Ejemplo: En el agua hay 2 átomos del elemento hidrógeno y 1 átomo del elemento oxígeno formando la molécula H2O.
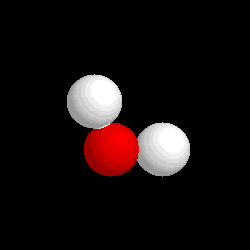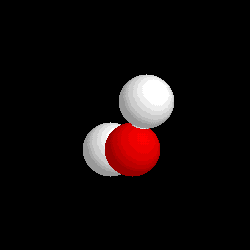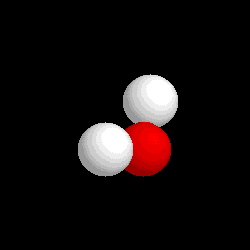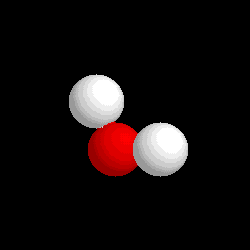 | Molécula de agua (H2O), formada por 2 átomos de hidrógeno (blancos) y 1 átomo de oxígeno (rojo) |
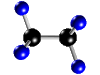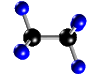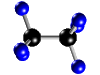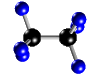 | Molécula de etano (C2H6), formada por 2 átomos de carbono (negros) y 6 átomos de hidrógeno (azul) |
 | Molécula de butano (C4H10), formada por 4 átomos de carbono (negros) y 10 átomos de hidrógeno (blancos) |
Cuando una sustancia pura está formada por un solo tipo de elemento, se dice que es una sustancia simple. Esto ocurre cuando la molécula contiene varios átomos pero todos son del mismo elemento. Ejemplo: Oxígeno gaseoso (O2), ozono (O3), etc. Están constituidas sus moléculas por varios átomos del elemento oxígeno.

* Las mezclas se encuentran formadas por 2 ó más sustancias puras. Su composición es variable. Se distinguen dos grandes grupos: Mezclas homogéneas y Mezclas heterogéneas.
- Mezclas homogéneas: También llamadas Disoluciones. Son mezclas en las que no se pueden distinguir sus componentes a simple vista. Ejemplo: Disolución de sal en agua, el aire, una aleación de oro y cobre, etc.

- Mezclas heterogéneas: Son mezclas en las que se pueden distinguir a los componentes a simple vista. Ejemplo: Agua con aceite, granito, arena en agua, etc.
 |  |
 |
En esta página encontrarás más información sobre elementos, compuestos y mezclas.
En esta página encontrarás un esquema sobre lo visto anteriormente y una actividad para practicar.
Realiza las siguientes actividades.
Los procedimientos físicos más empleados para separar los componentes de una mezcla heterogénea son: la filtración, ladecantación y la separación magnética. Estos métodos de separación son bastante sencillos por el hecho de que en estas mezclas se distinguen muy bien los componentes.
- Filtración: Este procedimiento se emplea para separar un líquido de un sólido insoluble. Ejemplo: Separación de agua con arena. A través de materiales porosos como el papel filtro, algodón o arena se puede separar un sólido que se encuentra suspendido en un líquido. Estos materiales permiten solamente el paso del líquido reteniendo el sólido.
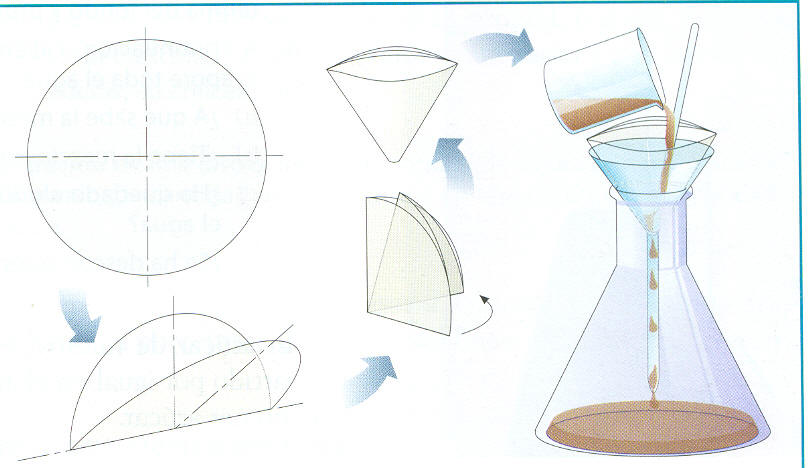 |  |
- Decantación: Esta técnica se emplea para separar 2 líquidos no miscibles entre sí. Ejemplo: Agua y aceite. La decantación se basa en la diferencia de densidad entre los dos componentes, que hace que dejados en reposo, ambos se separen hasta situarse el más denso en la parte inferior del envase que los contiene. De esta forma, podemos vaciar el contenido por arriba (si queremos tomar el componente menos denso) o por abajo (si queremos tomar el más denso).
En la separación de dos líquidos no miscibles, como el agua y el aceite, se utiliza un embudo de decantación que consiste en un recipiente transparente provisto de una llave en su parte inferior. Al abrir la llave, pasa primero el líquido de mayor densidad y cuando éste se ha agotado se impide el paso del otro líquido cerrando la llave. La superficie de separación entre ambos líquidos se observa en el tubo estrecho de goteo.
 |  |  |  |

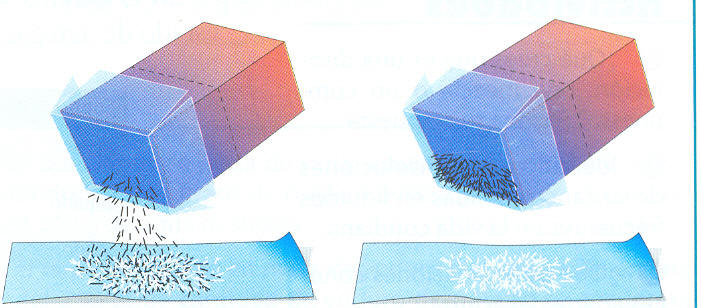
- Separación magnética: Esta técnica sirve para separar sustancias magnéticas de otras que no lo son. Al aproximar a la mezcla el imán, éste atrae a las limaduras de hierro, que se separan así del resto de la mezcla.
 |  |
En esta página puedes ver ejemplos de separaciones de mezclas heterogéneas.
Realiza las siguientes actividades.
Una disolución es una mezcla homogénea formada por 2 ó más sustancias puras en proporción variable. Las disoluciones pueden ser binarias (2 componentes), ternarias (3 componentes), etc. Ejemplo: Una mezcla de agua con sal es una disolución.
El componente de la disolución que se encuentra en mayor cantidad se llama disolvente y el o los que aparecen en menor cantidad se llaman solutos. Ejemplo: En una disolución de sal en agua, la sal es el soluto y el agua es el disolvente.
Las disoluciones binarias se clasifican según el estado de agregación en que se encuentran soluto y disolvente. en el siguiente cuadro podemos verlo:
| SOLUTO | DISOLVENTE | DISOLUCIÓN | EJEMPLO |
| GAS | GAS | GAS | AIRE  |
| LÍQUIDO | NIEBLA | ||
| SÓLIDO | POLVO EN EL AIRE | ||
| GAS | LÍQUIDO | LÍQUIDO | AMONIACO COMERCIAL |
| LÍQUIDO | ALCOHOL Y AGUA | ||
| SÓLIDO | SAL Y AGUA | ||
| GAS | SÓLIDO | SÓLIDO | HIDRÓGENO EN PALADIO |
| LÍQUIDO | AMALGAMAS (MERCURIO Y METAL) | ||
| SÓLIDO | ACERO INOXIDABLE |
3.1.- Concentración de una disolución
Las disoluciones pueden clasificarse en concentradas o diluidas según la cantidad de soluto sea grande o pequeña con respecto a la cantidad de disolvente. Pero estos términos son cualitativos, no dan una cantidad exacta medible. Para ello, se emplea el término concentración.
La concentración de una disolución es la cantidad de soluto que hay disuelto en una determinada cantidad de disolvente o en una determinada cantidad de disolución.
Existen distintas formas de expresar la concentración de una disolución:
No hay comentarios:
Publicar un comentario